Татьяна Ефимова предлагает статью на тему: "паллиативная помощь при лейкозе" с детальным описанием.
Содержание
Онкологическое заболевание кроветворной системы (красного костного мозга), при котором происходит злокачественное перерождение лейкоцитов (белых клеток крови), которые утрачивают способность выполнять свои функции, но при этом продолжают неконтролируемо делиться (увеличиваясь в количестве), вытесняют здоровые клетки крови, проникают в лимфоузлы, селезенку и другие органы, вызывая в них ряд патологических изменений.
Лейкозом болеет 2-3% всех онкобольных в мире. В России заболевают около 4000-5000 человек в год.
1. Связанные с неправильным образом жизни: употребление алкогольных напитков, курение и жевания табака;
2. Ослабление иммунитета, в частности – тяжелые вирусные инфекции: доказательство – вспышки лейкоза у детей после эпидемии гриппа;
3. Радиоактивное облучение. После воздействия очень высоких доз радиации возрастает риск развития острого миелобластного лейкоза, хронического миелолейкоза или острого лимфобластного лейкоза; частое применение лучевой терапии в качестве метода лечения; избыточное применение рентгенографических исследований, например, в стоматологии;
4. Контакт с химическими реагентами (проф. вредность): в особенности вреден бензол;
5. Химиотерапия: после лечения препаратами группы цитостатики возникает риск развития лейкемии;
6. Хромосомные наследственные заболевания: синдром Дауна и другие.
7. Заболевания крови – например, миелодиспластический синдром.
8. Наследственная предрасположенность к онкологическим заболеваниям: зарегистрированы случаи наследования хронического лимфолейкоза, где наследуется нестабильность генома, являющаяся предрасполагающим фактором к лейкозной трансформации.
Формы и типы. Лейкоз имеет несколько разновидностей, которые различаются скоростью развития заболевания и количеством лейкоцитов. Выделяют четыре вида лейкоза:
Острый лимфобластный лейкоз – наиболее часто встречается у детей;
Острый миелоидный лейкоз;
Хронический лимфоцитарный лейкоз – чаще возникает у взрослых старше 55 лет. Дети почти не болеют этой формой лейкоза. Были выявлены случаи заболевания у нескольких членов одной семьи.
Хроническая миелоидная лейкемия – в основном регистрируется только у взрослого населения.
По клиническому течению лейкемия бывает:
Острая: быстро прогрессирует, истощая организм пациента в короткие сроки.
Хроническая: прогрессирует медленно, симптомы заболевания могут не проявляться годами.
По количеству лейкоцитов выделяют следующие формы лейкозов:
Лейкемическая: число лейкоцитов более 50 тысяч,
Сублейкемическая: до 50 тысяч клеток,
Лейкопеническая: содержание лейкоцитов ниже нормы.
В зависимости от вида клеток различают формы лейкемии:
Лимфобластную – поражаются клетки крови, которые называются лимфоцитами.
Миелобластную – поражаются клетки – миелоциты.
Клинические проявления. Существуют общие признаки заболевания, которые нарастают вместе с числом измененных лейкоцитов, которые скапливаются в некоторых органах, вызывая характерные нарушения их работы. Острая форма лейкемии не переходит в хроническую, это две самостоятельные формы заболевания. Хроническая лейкемия может годами протекать бессимптомно, или симптомы будут «размыты» (незначительное повышение температуры тела при отсутствии инфекции, снижение массы тела, повышенное потоотделение по ночам, незначительно увеличенные лимфатические узлы и/или селезенка) и диагностироваться только на основании клинического анализа крови.
Общие симптомы заболеваний крови:
Повышение температуры тела без наличия очевидной причины;
Появление потливости в ночные часы;
Повышенная утомляемость, постоянное ощущение слабости и/или усталости;
Снижение аппетита в целом или к определенному виду пищи, непрекращающаяся тошнота; рвота без последующего чувства облегчения;
Немотивированное снижение массы тела за короткий промежуток времени
Ощущение болей в костях или в суставах; постоянные или частые головные боли, в том числе не поддающиеся воздействию лекарственных средств;
Возникновение нарушения координации движений;
Одышка при незначительной физической нагрузке;
Появление синяков/ кровоподтеков/гематом при незначительном травмировании кожного покрова, области сустава(ов);
Возникновение кровотечения при незначительном травмировании (особенно, если оно долго не останавливается, но ранее при аналогичных ситуациях оно не возникало, или возникало, но останавливалось за более короткий промежуток времени);
Немотивированные носовые кровотечения, кровоточивость десен;
Частые инфекционные заболевания (ОРВИ);
Вздутие живота и/или болезненные ощущения в правой и/или левой половинах живота / левом и/или правом подреберьях;
Увеличение лимфатических узлов в шейной, подмышечной и/или паховой областях
Отечность в паху, вызывающая выраженный дискомфорт и болевой синдром;
Нарушение зрения в виде «тумана» перед глазами (изменения на глазном дне).
Острая форма лейкемии подразделяется на стадии:
Начальная: характеризуется незначительными изменениями в составе крови; проявляется ослаблением иммунитета, как следствие – частыми простудными заболеваниями, и нередко остаётся не диагностированной;
Развёрнутая: проявляется анемией, геморрагическими явлениями (кровотечениями, кровоподтёками), увеличением лимфоузлов, печени, селезёнки, снижением веса, ухудшением общего состояния; в составе крови – большое количество незрелых клеток;
Терминальная: характеризуется тяжёлым общим состоянием, наличием вторичных опухолей в разных органах с выраженным нарушением их функции, поражением дыхательной, сердечно-сосудистой и нервной систем.
Характерные симптомы лейкемии зависят от формы заболевания.
Острый лимфобластный лейкоз :
Повышение температуры тела до высоких цифр при любом инфекционном заболевании;
Чувство слабости при незначительной физической нагрузке;
Увеличение лимфатических узлов всех групп;
Ощущение болей в костях и суставах;
Боли в подреберьях;
Слабость, повышенная утомляемость;
Тошнота, рвота, нарушения координации;
Озноб без признаков инфекционных заболеваний;
Увеличение над/подключичных лимфатических узлов;
Боли в костях нижних конечностей, вдоль позвоночника, иногда развивается остеопороз;
Постоянные немотивированные кровотечения, подкожные кровоизлияния при незначительных травмах.
Хронический лимфобластный лейкоз:
Немотивированно увеличенные группы лимфатических узлов;
Болезненные ощущения в подреберных областях;
Постоянные инфекционные заболевания (ОРВИ и др.);
Немотивированные носовые кровотечения.
1. Хроническая миелоидная лейкемия:
Повышенная утомляемость и снижение работоспособности;
Частые инфекционные заболевания;
Появление одышки в состоянии покоя и после незначительной физической нагрузки;
Увеличение печени и селезенки;
Постоянное ощущение тошноты с рвотными позывами;
Повышение температуры тела;
Частые головные боли;
Дезориентация в пространстве, нарушения координации движений;
Боль в костях, суставах.
Диагностика. Включает следующие обязательные этапы:
Опрос – подробное выяснение жалоб, истории заболевания и жизни пациента, наличие патологии у ближайших родственников.
Осмотр по системам и органам для выявления нарушений: пропальпировать группы лимфатических узлов, область печени и селезенки, так как при лейкемии они могут быть увеличены.
Л абораторные методы исследования:
Клинический анализ крови: увеличение количества лейкоцитов и снижение количества других клеток крови.
Коагулограмма – анализ показателей свертываемости крови.
Иммунограмма – исследование основных показателей иммунной системы человека.
Дополнительные методы обследования:
Пункционная биопсия костного мозга с последующим гистологическим исследованием – для определения вида лейкемии (стернальная пункция и трепанобиопсия);
Пункционная биопсия лимфатических узлов;
Спинномозговая пункция – для выявления незрелых клеток крови, их идентификации и определения чувствительности к тем или иным химиопрепаратам.
Инструментальные методы исследования:
Ультразвуковое исследование (УЗИ);
Компьютерная томография (КТ);
Магнитно-резонансная томография (МРТ).
Лечение. Несмотря на высокую злокачественность и тяжесть заболевания, лейкемия хорошо поддаётся лечению современными средствами:
-
- Химиотерапия.
- Лучевая терапия: с целью разрушения раковых клеток используют высокие дозы ионизирующего облучения. Происходит уменьшение увеличенных лимфатических узлов, селезенки. Данный вид терапии используют перед трансплантацией костного мозга и стволовых клеток.
Гемосорбция – метод лечения, направленный на удаление из крови различных токсических продуктов и регуляцию гемостаза путем контакта крови с сорбентом вне организма.
Таргетная терапия – лечение препаратами, которые блокируют рост и распространение раковых клеток, посредством воздействия на специфические молекулы, которые участвуют в развитии опухолевой клетки.
Трансплантация костного мозга (в том числе аутотрансплантация).
Трансплантация донорских стволовых клеток (аллогенной трансплантации): на роль донора чаще всего подходят родные братья или сестры пациентов.
Профилактика. Специфических методов профилактики против лейкемии не разработано. Следует вести здоровый образ жизни, включающий в себя рациональное питание, дозированные физические нагрузки, полноценный отдых и сон, снижение стрессов.
Старайтесь избегать дополнительных рисков: чрезмерного употребления алкоголя, табака, частого радиоактивного излучения и контакта с опасными химикатами. Не пропускайте плановое профилактические медицинские осмотры, включая клинический анализ крови.
Особенности течения лейкозов у детей
Тема 2.3.11 Сестринский процесс при лейкозах.
· Лейкозы: определение, этиология, патогенез, клиника, диагностика, прогноз, лечение, профилактика.
· Особенности течения лейкозов у детей.
· Особенности течения лейкозов у пожилых.
· Уход, сестринский процесс при лейкозах.
· Паллиативная помощь при лейкозах.
Лейкозы (лейкемии) — своеобразные злокачественные поражения кроветворных органов, среди которых выделяют различные варианты (лимфаденоз, миелоз и др.), иногда объединяя их термином «гемобластозы».
Этиология
Причинами, приводящими к острому лейкозу, могут быть ионизирующее излучение, воздействие химических веществ (бензол, продукты перегонки нефти, цитостатики и некоторые другие лекарственные средства), иммунодефициты, наследственные хромосомные дефекты и др. Хронический лимфолейкоз имеет наследственный характер.
Патогенез
Лейкозы характеризуются угнетением нормального кроветворения, замещением нормального костномозгового кроветворения пролиферацией незрелых, менее дифференцированных и функционально активных клеток (при острых лейкозах) или резким увеличением количества зрелых лимфоидных клеток в крови, лимфатических узлах, селезенке, печени (при хронических). Развитие обусловлено нарушением синтеза ДНК кроветворной клетки, изменением генетического кода, бесконтрольными ростом и дифференцировкой определенного клона кроветворных клеток и их метастазированием в различные органы.
Формы лейкозов.
Выделяют лейкемические (с резким увеличением числа лейкоцитов в периферической крови), сублейкемические и алейкемические формы лейкозов. По цитохимическим исследованиям (определение ферментов, характерных для разных бластных клеток) различают лимфобластные и миелобластные лейкозы.
Клиническая картина
Проявления заболевания зависит от формы процесса и его течения — острого или хронического. Основным симптомом являются резкие сдвиги в показателях гемограммы (клеточного состава крови), которые иногда обнаруживают случайно, а в других случаях на фоне явлений интоксикации с поражением различных органов я систем.
На этом фоне имеется слабость, утомляемость, анемия, нарушение функции желудочно-кишечного тракта (снижение аппетита, тошнота, рвота), значительное повышение температуры, увеличение печени, селезенки, лимфатических узлов, боли в костях. Затем присоединяется кахексия (снижение массы тела), явления геморрагического диатеза (петехии, экхимозы; кровотечения из слизистых оболочек — носовые кровотечения, подкожные кровоизлияния, внутренние кровотечения).
Для острого лейкоза характерно внезапное начало с высокой лихорадкой, нередко в сочетании с ангиной, стоматитом и кровоточивостью.
При хронических формах заболеваний крови длительность их составляет несколько лет (от 1 года до 5–6 и более лет) с периодами временного улучшения (ремиссии) в течение нескольких месяцев и последующего возобновления клинических симптомов.
Диагностика
Диагноз злокачественных болезней крови устанавливают на основании изучения пунктата костного мозга (обычно грудины) в сопоставлении со всеми клиническими проявлениями.
Наличие бластов в костном мозге подтверждает диагноз острого лейкоза. Для идентификации подтипа лейкоза применяют гистохимические, иммунологические и цитогенетические методы исследования. Иммуногистохимическое исследование (определение клеточного фенотипа) необходимо для уточнения иммунологического варианта лейкоза, влияющего на схему лечения и клинический прогноз.
При хроническом лимфолейкозе достаточно выявления абсолютного лимфоцитоза, представленного зрелыми клетками в мазке периферической крови. Подтверждающие данные — инфильтрация костного мозга зрелыми лимфоцитами, увеличение селезенки и лимфаденопатия (увеличение и болезненность лимфоузлов).
Лечение
Лечение при острый лейкозах проводят в гематологических отделениях и институтах. Применяют химиотерапию, лучевую терапию, гормоны, а также общеукрепляющие средства. Благодаря комплексному лечению удается продлить период ремиссии и жизнь этих больных.
Профилактика инфекций — главное условие выживания пациентов с нейтропенией (снижением количества лейкоцитов в крови), возникшей вследствие химиотерапии. Поэтому необходима полная изоляция пациента, строгий санитарно-дезинфекционный режим (частые влажные уборки, проветривание и кварцевание палат; использование одноразового инструментария, стерильной одежды медицинского персонала). С профилактической целью назначают антибиотики, противовирусные препараты.
Трансплантация костного мозга — метод выбора при острых миелобластных лейкозах и при рецидивах всех острых лейкозов. Перед операцией проводят химиотерапию в сверхвысоких дозах, изолированно или в сочетании с лучевой терапией. При этом методе лечения возникают проблемы, связанные с совместимостью — острые и отсроченные реакции, отторжение трансплантата и др. При отсутствии совместимых доноров используют аутотрансплантацию костного мозга, взятого у самого пациента в период ремиссии. Максимальный возраст для трансплантации — 50 лет. Аутологичную трансплантацию можно проводить пациентам старше 50 лет при отсутствии органных поражений и общем соматическом благополучии.
При клинических проявлениях анемии, риске кровотечений, перед предстоящим введением цитостатиков проводят заместительную терапию, переливание эритроцитарной массы или свежей тромбоцитарной массы. При компенсированном состоянии больного следует ограничить показания к заместительной терапии, во избежание заражения посттрансфузионным гепатитом и нежелательной сенсибилизации.
При хроническом лимфолейкозе лечение консервативное, не изменяет продолжительность жизни. В ранних стадиях, как правило, нет необходимости в химиотерапии. На поздних стадиях — химиотерапия в сочетании с глюкокортикоидами или без них; тотальное облучение организма в низких дозах.
Прогноз
Прогноз у детей с острым лимфолейкозом хороший: у 95% и более наступает полная ремиссия. У 70–80% больных проявлений болезни нет в течение 5 лет, их считают излечившимися. При возникновении рецидива в большинстве случаев можно достичь второй полной ремиссии. Больные со второй ремиссией — кандидаты на трансплантацию костного мозга с вероятностью долговременного выживания в 35–65% случаев.
Прогноз у больных острым миелобластным лейкозом относительно неблагоприятный. У 75% больных, получающих адекватное лечение с использованием современных химиотерапевтических схем, достигают полной ремиссии, 25% больных погибают (длительность ремиссии — 12–18 мес). Больным моложе 30 лет после достижения первой полной ремиссии можно проводить трансплантацию костного мозга. У 50% молодых больных, подвергшихся трансплантации, развивается длительная ремиссия.
Прогноз у больных с хроническим лимфолейкозом относительно благоприятный. Длительность жизни в отдельных случаях может достигать 15–20 лет.
Профилактика
Поскольку причинами, предрасполагающими к острому лейкозу, могут быть ионизирующее излучение, влияние химических веществ, нужно по возможности избегать лишнего контакта с этими вредными факторами.
Лица с иммунодефицитами, наследственными хромосомными дефектами, а также имеющие в роду хронический лимфолейкоз, должны помнить о своей склонности к заболеванию и осознанно относиться к профилактическим осмотрам.
Особенности течения лейкозов у детей.
Клиника: В начальном периоде острого лейкоза выражены симптомы интоксикации — повышенная утомляемость, слабость, недомогание, снижение аппетита, нарушение сна, незначительный подъем температуры.
Кожные покровы и слизистые оболочки становятся бледными, иногда на них появляются незначительные кровоизлияния.
В периоде разгара к ним присоединяются боли в трубчатых костях (бедренных и большеберцовых) и позвоночнике, которые связаны с лейкемической инфильтрацией костного мозга. Наиболее ярким проявлением этого периода являются кровоизлияния в кожу, слизистые оболочки, суставные полости, головной мозг. К ним могут присоединиться кровотечения из десен, носа, желудочно-кишечного тракта и т.д. Увеличиваются все группы лимфатических узлов, а также печень и селезенка. Иногда наблюдается симметричное увеличение слюнных, подчелюстных, околоушных и слезных желез, что придает лицу специфический одутловатый вид. Одним из частых проявлений лейкоза являются язвенно-некротические поражения кожи, слизистых оболочек и кишечника с развитием при этом ряда заболеваний.
Нередко выявляются поражения органов дыхания, сердечнососудистой системы, почек.
При вовлечении в патологический процесс нервной системы (нейролейкоз) у ребенка отмечается головная боль, тошнота, рвота, нарушение сознания, судороги, параличи и парезы, кома.
Паллиативная помощь при лейкозе
Острый миелоидный лейкоз (ОМЛ) — болезнь пожилых людей. Значительное большинство (60—70 %) таких больных вообще не включают в клинические исследования, поэтому ни о каких объективных результатах лечения у них говорить не приходится. Даже в рамках уже идущих исследований процент зарегистрированных пожилых больных, но не рандомизированных составляет около 30.
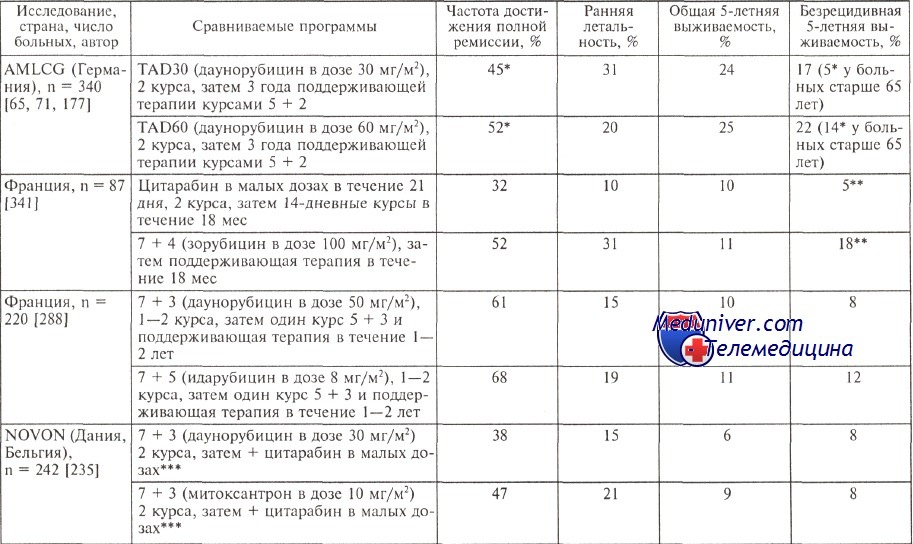
Несомненно, лечить пожилых больных надо, но однозначных рекомендаций, как их лечить, нет. Все рекомендации очень субъективны и обусловлены множеством дополнительных факторов, зависящих чаще всего от соматического статуса пациента в возрасте старше 60 лет. В таблице представлен анализ результатов европейских исследовательских групп по лечению пожилых больных.
Очевидно, что ни увеличение дозы даунорубицина с 30 до 60 мг/м2, ни применение цитарабина в малых дозах, идарубицина и новантрона вместо даунорубицина (правда, в сниженных на 1/3 дозах) не изменило общей выживаемости пациентов ни в одном исследовании. Следует, однако, выделить показатели, полученные в немецком исследовании: 24 и 25 % всех пожилых больных острым миелоидным лейкозом (ОМЛ) переживают 5-летний рубеж по сравнению с 6—11 % в других исследованиях.
По-видимому, имеет значение общий подход, используемый учеными в AMLCG, — интенсивная индукция (принцип двойной индукции) и длительная трехлетняя поддерживающая терапия. Интересно, что для больных старше 65 лет немецкие исследователи установили значимые различия по безрецидивной выживаемости: 22 % больных пережили без рецидива 5-летний рубеж при использовании 60 мг/м2 даунорубицина и только 5 % больных, получавших препарат в дозе 30 мг/м2.
Результаты лечения больных старше 60 лет
* Статистически достоверные различия.** Цифры не безрецидивной выживаемости, а продолжительности полной ремиссии в течение 3 лет; доза 100 мг зорубицина соответствуют 50 мг даунорубицина.
*** У больных, которым проводили поддерживающую терапию цитарабином в малых дозах (6 курсов по 14 дней), существенно выше безрецидивная выживаемость — 14 — 5 % соответственно.
Все остальные подходы, как видно из представленных в таблице данных, позволяют добиться 5—8 % безрецидивной выживаемости.
По-видимому, у пожилых больных целесообразно проводить индукцию по стандартной программе 7 + 3 с дозой даунорубицина 45 мг/м2. Следует помнить, что больным пожилого возраста программы интенсификации с помощью высокодозного цитарабина не показаны в период индукции ремиссии. Рекомендуется после проведения одного стандартного курса индукции 2 курса консолидации по той же схеме, только дозу даунорубицина снижают до 30 мг/м2.
Необходимо отметить, что роль очень интенсивной консолидации у пожилых больных острым миелоидным лейкозом сомнительна. По данным все той же немецкой группы по изучению острого миелоидного лейкоза (AMLSG), результаты применения короткой высокодозной консолидации (программа НАМ) после двойной индукции у пожилых пациентов значительно хуже, чем длительной поддерживающей терапии обычными малоинтенсивными ротирующими курсами.
Таким образом, после завершения 3 курсов индукции и консолидации по программе 7+3 пожилым больным проводят поддерживающее лечение по следующей схеме: цитарабин 5 дней в дозе 100 мг/м2 суммарно в день подкожно в сочетании либо с даунорубицином по 30 мг/м2 в день в течение 2 дней (до общей дозы 650 мг/м2, затем эти курсы не проводят), либо с циклофосфаном — 600 мг/м2 1 день, либо с 6-тиогуанином по 50 мг/м2 (или 6-меркаптопурином) 2 раза в день в течение 5 дней. Интервал между курсами составляет 1 мес. Общая длительность лечения 3 года.
Если после двух курсов 7 + 3 полная ремиссия не достигнута, больных переводят на программу лечения цитарабином в малых дозах (10 мг/м2 2 раза в день подкожно в течение 3— 4 нед). При отсутствии эффекта после 2—3 курсов цитарабина в малых дозах назначают паллиативную терапию (гидроксимочевина, 6-меркаптопурин, трансфузии компонентов крови). Больным старше 60 лет с тяжелой сопутствующей патологией, а также практически всем больным старше 70 лет можно рекомендовать курсы цитарабина в малых дозах как первую линию терапии. Курсы проводят в течение 3 лет с интервалом 4—5 нед.
При отсутствии эффекта после двух курсов цитарабина в малых дозах и при сохранном соматическом статусе больного можно рекомендовать стандартный курс 7+3, а в ряде случаев программу НАМ, доза цитарабина в которой составляет 1 г/м2. Особые проблемы возникают, если больные старше 80 лет. В этих случаях до сих порпродолжает обсуждаться вопрос о необходимости химиотерапии вообще.
Острый лимфобластный лейкоз
Суть болезни
Лейкоз, или лейкемия – заболевание костного мозга, в обиходе иногда называемое «раком крови». При лейкозе нарушено нормальное кроветворение: производится избыточное количество аномальных незрелых клеток крови, обычно предшественников лейкоцитов. Эти бластные клетки, размножаясь и накапливаясь в костном мозге, мешают выработке и функционированию нормальных клеток крови, что и обусловливает основные симптомы заболевания. Кроме того, эти опухолевые клетки могут накапливаться в лимфоузлах, печени, селезенке, центральной нервной системе и других органах, также вызывая появление специфических симптомов.
Как известно, различные клетки крови развиваются по-разному и имеют разных предшественников – то есть относятся к различным линиям кроветворения (см. схему в статье «Кроветворение»). Линия кроветворения, приводящая к появлению лимфоцитов, называется лимфоидной; остальные же лейкоциты относятся к миелоидной линии. Соответственно, различают лейкозы из клеток-предшественников лимфоцитов (такие лейкозы называют лимфобластными, лимфоцитарными или просто лимфолейкозами) и из предшественников других лейкоцитов (миелобластные, миелоидные, миелолейкозы).
Острый лимфобластный лейкоз (ОЛЛ) – самый распространенный вид лейкоза у детей, но это заболевание нередко встречается и во взрослом возрасте. Термин «острый» означает быстрое развитие болезни, в противоположность хроническому лейкозу. Термин «лимфобластный» означает, что незрелые клетки, составляющие основу болезни, являются лимфобластами, то есть предшественниками лимфоцитов.
Частота встречаемости и факторы риска
На долю ОЛЛ приходится 75-80% всех опухолевых заболеваний кроветворной системы у детей (3-4 случая на 100 тысяч детей в год). Именно ОЛЛ – самое распространенное онкологическое заболевание у детей. Чаще всего ОЛЛ возникает в возрасте до 14 лет; пик детской заболеваемости приходится на возраст 2-5 лет. У мальчиков эта болезнь встречается чаще, чем у девочек.
Вероятность возникновения ОЛЛ несколько повышена у людей, ранее получавших лечение от какой-либо другой болезни (обычно злокачественной опухоли) с использованием облучения или определенных видов цитостатической химиотерапии. Также риск ОЛЛ повышен у детей с некоторыми генетическими нарушениями – например, с синдромом Дауна, нейрофиброматозом типа I или первичными иммунодефицитными состояниями.
Риск заболеть для ребенка выше среднего, если у его брата- или сестры-близнеца уже был диагностирован лейкоз.
Впрочем, в большинстве случаев лейкоза не удается обнаружить никакого из перечисленных факторов риска, и причины, вызвавшие болезнь, остаются неизвестными.
Признаки и симптомы
ОЛЛ характеризуется множеством различных признаков и у разных больных может проявляться по-разному. Большинство наблюдаемых симптомов, однако, обусловлено тяжелыми нарушениями кроветворения: избыток аномальных бластных клеток при ОЛЛ сочетается с недостаточным количеством нормальных функциональных клеток крови.
Обычно наблюдаются слабость, бледность, снижение аппетита, потеря веса, учащенное сердцебиение (тахикардия) – проявления анемии и опухолевой интоксикации. Недостаток тромбоцитов проявляется мелкими кровоизлияниями на коже и слизистых оболочках, кровотечениями из десен, носовыми и кишечными кровотечениями, кровоподтеками, синяками. Из-за накопления бластных клеток часто увеличиваются лимфоузлы – в частности, шейные, подмышечные, паховые. Нередко увеличиваются также печень и селезенка – как говорят, возникает гепатоспленомегалия.
Часто наблюдаются боли в костях и суставах, иногда возникают патологические (то есть вызванные заболеванием) переломы костей. Из-за недостаточного количества нормальных зрелых лейкоцитов возможны частые инфекции. Повышение температуры может наблюдаться как в связи с возникшей на фоне лейкоза инфекцией, так и из-за опухолевой интоксикации. Иногда одним из проявлений острого лейкоза является продолжительная ангина, плохо поддающаяся терапии антибиотиками.
В некоторых случаях ОЛЛ вызывает изменения и в других органах: глазах, почках, яичках у мальчиков и яичниках у девочек, причем у мальчиков поражение половых органов наблюдается чаще. Нередко возникает поражение центральной нервной системы – нейролейкемия.
Так как все наблюдаемые симптомы могут быть связаны и с другими заболеваниями и не специфичны для ОЛЛ, перед началом лечения необходима лабораторная диагностика, которая в срочном порядке производится в больничных условиях.
Диагностика
При ОЛЛ возникают изменения в обычном клиническом анализе крови: понижены уровни эритроцитов и тромбоцитов, появляются бластные клетки. Очень высокий лейкоцитоз возможен, но, вопреки распространенному мнению, наблюдается не во всех случаях. В целом же надежно поставить диагноз можно только при исследовании образца костного мозга; для этой цели необходима костномозговая пункция.
При морфологическом исследовании диагноз «острый лимфобластный лейкоз» ставится при обнаружении более 25% бластных клеток в костном мозге. Но обязательно производятся более тонкие исследования: цитохимическое (окрашивание клеток, позволяющее более точно установить их природу), цитогенетическое (изучение строения хромосом в лейкемических клетках), иммунофенотипирование (изучение белковых молекул на поверхности клеток). Дело в том, что при диагностике очень важно не только надежно отличить ОЛЛ от острого миелоидного лейкоза, но и определить конкретный вариант ОЛЛ, поскольку он сильно влияет на терапию и прогноз заболевания.
Так, ОЛЛ может быть B-клеточным (около 80% случаев) и T-клеточным, в зависимости от того, относятся ли лейкемические клетки к B- или T-лимфоцитарной линии. В зависимости от «степени зрелости» бластных клеток среди как В-, так и Т-клеточных лейкозов выделяют несколько вариантов; их установление в ходе иммунофенотипирования важно для определения стратегии лечения.
В ходе диагностики ОЛЛ также необходимо исследовать состояние центральной нервной системы. Анализ спинномозговой жидкости (ликвора) позволяет определить, нет ли у больного поражения центральной нервной системы – нейролейкемии. Образец ликвора для анализа получают посредством пункции спинномозгового канала.
Возможны и дополнительные диагностические процедуры для исследования пораженных лимфоузлов и внутренних органов – компьютерная томография (КТ), ультразвуковое исследование (УЗИ) и так далее.
Диагностические исследования позволяют для каждого конкретного больного определить ту или иную группу риска, от которой зависят прогноз заболевания и планируемое лечение. Так, говорят о стандартном риске, высоком риске и т.д. Отнесение к той или иной группе зависит от многих факторов. Перечислим некоторые из них.
- Возраст больного: менее благоприятным считается возраст до 1 года или старше 10 лет.
- Количество лейкоцитов: риск увеличивается при очень высоком лейкоцитозе в момент диагноза.
- Т-клеточный ОЛЛ у детей обычно определяет более высокий риск (худший прогноз) по сравнению с В-клеточным.
- Хромосомные аномалии в лейкемических клетках, связанные с числом хромосом и транслокациями. При некоторых из них усложняется лечение болезни и ухудшается прогноз. Так, особенно неблагоприятна филадельфийская хромосома – транслокация t(9;22). В то же время, например, транслокация t(12;21) связана с относительно хорошим прогнозом.
- Распространение ОЛЛ в другие органы, помимо костного мозга (например, возникновение нейролейкемии), определяет более высокий риск.
- При раннем или повторном рецидиве лейкоза риск значительно повышается.
Как упомянуто в предыдущем разделе, современное лечение ОЛЛ основано на разделении пациентов на группы риска – в зависимости от того, насколько вероятно у них достижение и сохранение ремиссии при одинаковой терапии. Соответственно, пациенты, относящиеся к группам более высокого риска (то есть те, у кого изначальный прогноз хуже), получают более интенсивную терапию, а в группах более низкого риска можно использовать менее интенсивную терапию и тем самым избегать излишней токсичности и тяжелых осложнений.
Терапия ОЛЛ, как правило, состоит из трех этапов:
Индукция ремиссии (то есть терапия, направленная на достижение ремиссии) проводится в течение нескольких первых недель лечения. Под ремиссией здесь подразумеваеся содержание менее 5% бластных клеток в костном мозге и отсутствие их в обычной (периферической) крови в сочетании с признаками восстановления нормального кроветворения.
В ходе индукции проводится интенсивная многокомпонентная химиотерапия лекарствами-цитостатиками, которые вызывают разрушение лейкемических клеток. На этом этапе могут применяться такие лекарства, как винкристин, гормоны-глюкокортикостероиды, аспарагиназа, антрациклины (даунорубицин и др.), иногда и другие препараты. Индукция позволяет достигнуть ремиссии более чем у 95% детей и у 75-90% взрослых с ОЛЛ.Консолидация (закрепление) ремиссии направлена на уничтожение остаточных аномальных бластных клеток во избежание рецидива заболевания. Общая продолжительность этого этапа составляет несколько месяцев и сильно зависит от конкретного протокола лечения. В ходе курсов терапии на этапе консолидации могут использоваться метотрексат, 6-меркаптопурин, винкристин, преднизолон, а также циклофосфамид, цитарабин, даунорубицин, аспарагиназа и т.д.
На этапах индукции и консолидации введение химиотерапевтических препаратов производится в основном внутривенно, в условиях больничного стационара или стационара одного дня.Поддерживающая терапия проводится для поддержания ремиссии, то есть для дополнительного снижения риска рецидива после этапов индукции и консолидации. Продолжительность поддерживающей терапии – 2-3 года. На этом этапе основными препаратами являются 6-меркаптопурин и метотрексат.
Поддерживающая терапия представляет собой этап наименее интенсивного лечения. Лекарства принимаются в виде таблеток, пребывание в больнице при этом не требуется.Для лечения и профилактики нейролейкемии на перечисленных этапах химиопрепараты должны вводиться интратекально, то есть в спинномозговой канал посредством люмбальных пункций. Иногда лекарства вводят в желудочки (особые полости) головного мозга через специальный резервуар Оммайя, который устанавливается под кожей головы. Основной препарат, используемый для интратекального введения при ОЛЛ, – метотрексат; дополнительно также применяются цитарабин и глюкокортикостероиды. У некоторых пациентов используется и облучение головы – краниальное облучение.
Существует также понятие реиндукции: это периодически повторяемые уже после достижения ремиссии циклы полихимиотерапии, аналогичные используемым при индукции. Реиндукция позволяет дополнительно снизить число лейкемических клеток и тем самым повысить «надежность» ремиссии.
К сожалению, несмотря на все перечисленные меры, иногда возникает рецидив ОЛЛ – костномозговой, экстрамедуллярный (то есть вне костного мозга – например, с поражением центральной нервной системы или яичек) или комбинированный. В этом случае проводится противорецидивная терапия. Выбор протокола лечения рецидива зависит от сроков его возникновения (ранний или поздний) и от того, является ли рецидив костномозговым или экстрамедуллярным. К сожалению, при раннем рецидиве шансы на успех терапии значительно снижаются.
В ходе лечения ОЛЛ может применяться трансплантация костного мозга от родственного или неродственного донора. Если по плану лечения предусмотрена трансплантация, то ее проводят после достижения ремиссии. Как правило, трансплантация показана только при высоком риске (например, после раннего рецидива), поскольку вероятность хорошего ответа на стандартную терапию при ОЛЛ в среднем высока, особенно у детей.
Химиотерапия ОЛЛ высокоэффективна, но зачастую тяжело переносится и может быть связана с серьезными побочными эффектами. Так, в процессе лечения подавляется кроветворение и бывают необходимы переливания компонентов донорской крови – тромбоцитов во избежание кровотечений при очень низком уровне собственных тромбоцитов больного, эритроцитов для борьбы с анемией. Переливания донорских лейкоцитов (гранулоцитов) применяются только в редких случаях при тяжелых инфекционных осложнениях.
В числе «обычных» побочных эффектов химиотерапии можно также назвать тошноту, рвоту, облысение. Серьезнае проблема связана с возможностью аллергических реакций на химиопрепараты, вплоть до анафилактического шока – жизнеугрожающего состояния, которое характеризуется отеком, затруднением дыхания, сильным зудом и т.д. Так, сравнительно часто встречается аллергия на аспарагиназу, и может быть необходимо использование аналогов этого препарата (онкаспар, эрвиназа).
Поскольку и лейкоз сам по себе, и используемая при его лечении химиотерапия резко снижают сопротивляемость организма различным инфекциям, то больным во время лечения необходимы эффективные антибактериальные и противогрибковые лекарства для профилактики и терапии инфекционных осложнений. Опасны как обычные, так и оппортунистические инфекции. В частности, серьезную проблему представляют такие грибковые инфекции, как кандидоз и аспергиллез.
Интенсивное лечение ОЛЛ накладывает серьезные ограничения на образ жизни больного. Необходимо соблюдать определенную диету и строгие гигиенические требования. Во избежание инфекций ограничиваются контакты с внешним миром. При очень низком уровне тромбоцитов нельзя не только допускать травмы, но даже, например, чистить зубы зубной щеткой – чтобы не спровоцировать кровотечение из десен. После достижения ремиссии строгость этих ограничений постепенно снижается. Врачи и медсестры сообщают каждому больному, что ему можно и что нельзя на текущем этапе лечения.
Без лечения ОЛЛ приводит к гибели больного в течение нескольких месяцев или даже недель. Однако использование современных протоколов лечения дает при ОЛЛ очень хороший результат: можно вылечить около 80% больных детей (некоторые источники приводят и более высокие цифры – например, до 85%). У взрослых, особенно пожилых, результаты хуже, но, тем не менее, примерно у 40% взрослых больных удается достичь стойкой ремиссии – то есть отсутствия рецидивов болезни в течение пяти и более лет, после чего человека можно считать здоровым.
✔ Обо мне ✉ Обратная связьПозвольте представиться. Меня зовут Татьяна. Я уже более 8 лет занимаюсь психологией. Считая себя профессионалом, хочу научить всех посетителей сайта решать разнообразные задачи. Все данные для сайта собраны и тщательно переработаны для того чтобы донести как можно доступнее всю необходимую информацию. Перед применением описанного на сайте всегда необходима ОБЯЗАТЕЛЬНАЯ консультация с профессионалами.